Norma ISO 15189 – Focus sulla qualità delle prestazioni di laboratorio
La norma ISO 15189 rappresenta un importante riferimento per il riconoscimento della competenza, ma l’obiettivo primario dell’accreditamento è il miglioramento degli outcome clinici e l’accrescimento del servizio erogato dai laboratori medici. Nel dicembre 2022 è stata pubblicata la quarta edizione della norma ISO 15189 “Medical laboratories – Requirements for quality and competence”, che annulla e sostituisce quella precedente del 2012.
La norma mira ad aumentare la qualità dei risultati rilasciati, ad assicurare la validità dei risultati ottenuti e ad evitare il rilascio di risultati di test errati. La nuova norma ISO 15189 si focalizza maggiormente sui rischi e sul benessere del paziente, e incentra i requisiti su aspetti strategici come il benessere dei pazienti e la soddisfazione degli utenti del servizio. Inoltre, è applicabile non solo ai laboratori medici, ma anche alle analisi decentrate (POCT Point-Of-Care-Testing). L’inclusione dei POCT pone questa opzione di analisi sullo stesso piano dei laboratori medici, grazie ai requisiti di qualità molto più stringenti rispetto al passato. Pertanto, la nuova 15189 incorpora i requisiti della norma relativa ai POCT ISO 22870:2016 che non sarà più applicata.
La norma ISO 15189 in Europa
L’accreditamento dei laboratori medici basato sui requisiti della norma ISO 15189 è oggi diffuso in Europa e nel mondo, sia in termini di accreditamento volontario che come requisito cogente in diversi Paesi europei come Regno Unito, Francia, Belgio, Olanda, Germania e Irlanda. La nuova regolamentazione, inoltre, è stata dichiarata “preferred standard” il 23 novembre 2022 a Bruxelles, dall’Assemblea Generale di EA (European co-operation for Accreditation).
La situazione in Italia
Al momento, nel nostro Paese solo alcune decine di laboratori sono accreditate in conformità con la ISO 15189:2012, ma il numero è destinato ad aumentare, proprio per la necessità di incontrare gli standard richiesti a livello europeo.
Infatti, nonostante tale accreditamento non sia obbligatorio, molte realtà della sanità pubblica stanno facendo il percorso di accreditamento, tra cui l’IRCSS, Centro di riferimento oncologico-Dipartimento della Ricerca e della Diagnostica avanzata dei tumori di Aviano, (Pordenone) e l’Unità Operativa Complessa Oncoemoatologia Pediatrica (UOC) dell’Azienda Ospedaliera-Università di Padova¹.
La Provincia Autonoma di Trento è ancora più avanti, infatti, nella Delibera 1020 del 23 giugno 2017 ha stabilito che l’autorizzazione è un prerequisito obbligatorio per ottenere e mantenere l’accreditamento istituzionale rilasciato dall’Autorità competente (la Provincia).
Tempistiche previste per l’accreditamento
ILAC (International Laboratory Accreditation) e EA hanno previsto un periodo di tre anni per la transizione degli accreditamenti dei laboratori già accreditati 15189:2012 che dovranno essere conformi alla ISO 15189:2022 dal 7 dicembre 2025.
Le novità
L’obiettivo di questa rinnovata versione è sottolineare l’importanza di alcuni requisiti relativi ad aspetti strategici per l’attività di laboratorio come garantire una pratica clinica di qualità, con risultati trasparenti e affidabili, in cui al centro ci sono il benessere e la sicurezza degli utenti, oltre alla soddisfazione delle esigenze del settore diagnostico. I capitoli standard sono stati ristrutturati e le sezioni presenti nella versione precedente sono stati completamente revisionati.
Sono state consolidate e ampliate le definizioni dei termini al fine di minimizzare le interpretazioni scorrette, anche nell’ottica di una maggiore multidisciplinarietà degli argomenti che riflette le esigenze e le caratteristiche dei laboratori medici di oggi. Le principali novità che possiamo ritrovare nella nuova norma e riguardano globalmente la gestione della qualità del personale, delle attrezzature e dei processi in tutte le fasi dell’analisi. Inoltre, al controllo di qualità interno, la nuova versione affianca una sezione relativa controllo di qualità esterno ancora più ampia.

Tracciabilità dei campioni e dei processi
Ad oggi un requisito fondamentale per i laboratori è la possibilità di risalire ai dati relativi a tutte le fasi del processo che è stato condotto con il minimo margine di errore. Per raggiungere tale obiettivo è necessario dotarsi di strumenti aggiornati e validati che permettano di mantenere le registrazioni complete e accurate di tutti i dati del percorso diagnostico.
Nella sezione 6.5 “Equipment calibration and metrological traceability” viene sottolineato che il laboratorio deve specificare i requisiti di calibrazione e di tracciabilità in modo che siano sufficienti a mantenere una comunicazione coerente dei risultati degli esami. Per i metodi quantitativi di un analita misurato, le specifiche devono includere requisiti di calibrazione e di tracciabilità metrologica.
I metodi qualitativi e i metodi quantitativi che misurano le caratteristiche e gli analiti discreti determinano la caratteristica da valutare e i requisiti necessari per la riproducibilità nel tempo.
Tracciabilità metrologica dei risultati di misura
a) Il laboratorio deve stabilire e mantenere la tracciabilità metrologica dei suoi risultati di misura mediante una catena documentata ininterrotta di calibrazioni, ciascuna delle quali contribuisce all’incertezza di misura, collegandola a un riferimento appropriato;
b) il laboratorio deve garantire che i risultati delle misurazioni siano riconducibili al massimo livello possibile di tracciabilità e al sistema internazionale di unità (SI) mediante:
– taratura effettuata da un laboratorio competente; oppure
– valori certificati dei materiali di riferimento forniti da un produttore competente con comprovata tracciabilità metrologica al SI;
c) qualora non sia possibile fornire la tracciabilità secondo 6.5.3 si applicano altri mezzi per garantire la fiducia nei risultati, tra cui, a titolo esemplificativo, i seguenti: risultati di procedure di misurazione di riferimento, metodi specifici o standard consensuali, chiaramente descritti e accettati come idonei all’uso previsto e garantiti da un confronto adeguato; misurazione del calibratore con un’altra procedura;
d) per gli esami genetici occorre stabilire la tracciabilità delle sequenze genetiche di riferimento.
e) per i metodi qualitativi, la tracciabilità può essere dimostrata mediante prove su materiali noti o su campioni precedenti sufficienti a dimostrare un’identificazione coerente e, nel caso, l’intensità della reazione.
Nella sezione “7.2.3 “Requests for providing laboratory examinations” (capitolo 7 “Process requirements”), sono compresi i criteri per le richieste di analisi di laboratorio, e anche qui la tracciabilità assume una maggiore importanza.
La richiesta d’esame deve fornire informazioni sufficienti a garantire:
– tracciabilità inequivocabile del paziente alla richiesta e al campione;
– identità e informazioni di contatto del richiedente;
– identificazione del l’esame(i) richiesto;
– possono essere fornite consulenze cliniche e tecniche informate e interpretazione clinica.
Le informazioni richieste per l’esame possono essere fornite in un formato o su un supporto ritenuto appropriato dal laboratorio e accettabile per l’utilizzatore.
Se necessario per la cura del paziente, il laboratorio comunica con gli utilizzatori o i loro rappresentanti per chiarire la richiesta dell’utilizzatore.
Anche la sezione 7.4.1.8 (capitolo 7 “Process requirements”) enfatizza l’importanza della tracciabilità delle eventuali modifiche ai risultati (amendments).
Modifiche ai risultati comunicati
Le procedure per il rilascio di risultati modificati o riveduti garantiscono che:
a) il motivo della modifica è registrato e incluso nella relazione riveduta, se del caso.
b) I risultati riveduti sono forniti solo sotto forma di un documento o di un trasferimento di dati supplementari, chiaramente identificati come riveduti, e sono indicati la data e l’identità del paziente nella relazione originale.
c) L’utente è informato della revisione.
d) Quando è necessario emettere una relazione completamente nuova, questa deve essere identificata in modo univoco e contenere un riferimento e una tracciabilità alla relazione originale che sostituisce.
e) Quando il sistema di segnalazione non è in grado di rilevare le revisioni, deve essere tenuto un registro di tali revisioni.
La fase preanalitica
Le norme indicate nelle standard ISO 15189:2022 sono focalizzate in modo preponderante sulla fase preanalitica. Le parti aggiornate relative alla fase preanalitica sono incluse nel paragrafo 7.2.4 “Primary sample collection and handling” (capitolo 7 “Process requirements”), di cui riportiamo un sunto delle parti che introducono le maggiori novità.
Il laboratorio deve avere delle procedure per la raccolta e la manipolazione dei campioni. Le informazioni dovranno essere disponibili per il personale responsabile della raccolta. Ogni deviazione dalla procedura prestabilita per la raccolta dovrà essere registrata. Il rischio potenziale e l’impatto sull’outcome del paziente di accettazione o rigetto del campione deve essere valutata, registrata e comunicata al personale dedicato.
Il laboratorio deve periodicamente revisionare i requisiti per il volume del campione, i device per la raccolta e i conservanti per ogni tipo di campione, se pertinente, per assicurare che non venga mai raccolto una quantità eccessiva o insufficiente di campione o che il campione sia raccolto in modo corretto in modo da preservare l’analita.
Il laboratorio deve fornire informazioni e istruzioni relative alle attività di pre-raccolta con dettaglio sufficiente al fine di assicurare che l’integrità del campione non sia compromessa.
Queste informazioni devono includere:
a) preparazione del paziente (ad es. istruzioni al caregiver, per l’operatore che raccoglie il campione e per il paziente);
b) tipo e quantità di campione primario che deve essere raccolto con descrizione del contenitore e di ogni additivo necessario e l’ordine corretto di raccolta dei campioni;
c) tempistica particolare di raccolta del campione, quando rilevante;
d) fornire informazioni cliniche rilevanti che possano impattare sulla raccolta del campione, o rilevanti per l’analisi o per l’interpretazione del risultato (ad es storia di somministrazione dei farmaci);
e) etichettatura del campione per un’identificazione inequivocabile del paziente e della fonte e del sito di raccolta, ed etichettatura dei diversi campioni provenienti dallo stesso paziente che dovranno essere raccolti, compresi slides o parti di tessuti diversi;
f) i criteri di laboratorio per l’accettazione o il rigetto del campione specifici per l’analisi richiesta.
Per garantire la sicurezza, l’accuratezza e l’appropriatezza clinica della raccolta del campione e della conservazione nella fase di pre-analisi il laboratorio deve fornire le istruzioni per:
a) la verifica dell’identità del paziente da cui è stato raccolto il campione primario;
b) la verifica e quando rilevante, la registrazione che il paziente incontra i requisiti per la fase preanalitica (status clinico come digiuno, tempo l’ultima dose di un farmaco, interruzione di una terapia; raccolta del campione in un determinato momento o intervallo di tempo);
c) raccolta dei campioni primari, con descrizione dei contenitori e di ogni additivo necessario, dell’ordine della raccolta dei campioni quando rilevante;
d) etichettatura dei campioni primari in modo da collegare in maniera inequivocabile il campione al paziente da cui sono stati raccolti;
e) registrazione dell’identità della persona che raccoglie il campione primario, data di raccolta e quando rilevante, registrazione dell’ora di raccolta;
f) requisiti per la separazione e la suddivisione del campione primario quando necessaria;
g) stabilizzazione e condizioni di conservazione adeguati prima che i campioni raccolti siano inviati al laboratorio;
h) smaltimento in sicurezza dei materiali utilizzati nel processo di raccolta.
A queste indicazioni si aggiungono indicazioni sul trasporto del campione e sulla sua ricezione in ottica di mantenimento dell’integrità e della bontà del campione e sulla gestione del rischio preanalitico sempre relativamente al campione raccolto.
Eccezioni all’accettabilità del campione:
a) il laboratorio deve disporre di un processo che consideri il miglior interesse del paziente nel ricevere le cure quando il campione è compromesso a causa di:
– Identificazione non corretta del paziente
– Instabilità del campione dovuta ad esempio ad un ritardo nel trasposto.
– Conservazione non corretta o temperatura scorretta durante il maneggiamento
– Contenitore non appropriato
– Volume di campione insufficiente.
b) Quando un campione clinicamente critico o insostituibile compromesso è accettato, dopo aver considerato il rischio per la sicurezza del paziente, la relazione finale indica la natura del problema e, se del caso, consiglia cautela nell’interpretare i risultati che possono essere interessati.
Trasparenza dei risultati
Le nuove raccomandazioni richiedono la produzione di documentazione ancora più rigorosa e completa, rispetto al passato, relativa ai processi e alle procedure. L’adeguamento della documentazione già in essere può essere un compito impegnativo per i laboratori e dotarsi di strumenti che possano facilitare e velocizzare tale processo è di grande supporto. Nella sezione 7.6 “Control of data and information management” troviamo i criteri per il controllo dei dati e gestione delle informazioni e del sistema informativo.
• Il laboratorio ha accesso ai dati e alle informazioni necessari per svolgere le attività di laboratorio
• Il laboratorio garantisce che siano specificate le autorità e le responsabilità per la gestione dei sistemi informativi, comprese la manutenzione e la modifica dei sistemi informativi che possono influire sulla cura dei pazienti.
• Il laboratorio è in ultima analisi responsabile dei sistemi informativi di laboratorio.
Il sistema (i sistemi) informativo utilizzato per la raccolta, l’elaborazione, la registrazione, la comunicazione, l’archiviazione o il recupero dei dati e delle informazioni d’esame è:
a) convalidato dal fornitore e verificato dal laboratorio relativamente alla funzionalità prima dell’introduzione. Qualsiasi modifica al sistema, compresa la configurazione del software di laboratorio o le modifiche al software commerciale, deve essere autorizzata, documentata e convalidata prima dell’implementazione;
b) documentato: la documentazione deve essere prontamente disponibile per gli utenti autorizzati, anche per il funzionamento quotidiano del sistema;
c) attuato tenendo conto della sicurezza informatica, per proteggere il sistema da accessi non autorizzati e proteggere i dati da manomissioni o perdite;
d) in un ambiente conforme alle specifiche del fornitore o, nel caso di sistemi non computerizzati, in condizioni che salvaguardino l’accuratezza della registrazione e delle trascrizioni manuali;
e) mantenuto in modo da garantire l’integrità dei dati e delle informazioni e che possa includere la registrazione dei guasti del sistema e le opportune azioni immediate e correttive.
Infine, i calcoli e i trasferimenti di dati devono essere verificati in modo appropriato e sistematico. Becton Dickinson grazie alla divisione BD Integrated Diagnostic Solution, offre soluzioni innovative, strumenti digitali e di automazione dei processi, che consentono una ottimale tracciabilità del campione e dei dati, consentendo la riduzione delle variabili preanalitiche che possono influenzare la raccolta del campione e del dato. Tali strumenti permettono la tracciabilità anche di eventi, materiali, operatori e prestazioni in questa delicata fase del processo, permettendo un controllo completo e la riduzione degli errori.
Competenza del personale
Come evidenziato dalla norma ISO 15189, i corsi di formazione sono un aspetto cruciale in quanto consentono di assicurare la presenza di personale sempre ben addestrato e aggiornato. Le richieste attuali in tema di formazione sono più stringenti rispetto al passato e viene richiesto la tracciabilità dei percorsi formativi. Ciò permette di verificare e monitorare la formazione del personale in modo costante e quindi di mantenere un’elevata qualità nelle fasi processuali dipendenti dall’operatore. L’investimento da parte dei laboratori nella formazione del personale è quindi un passo fondamentale per l’accreditamento ma può anche rappresentare una difficoltà, soprattutto in presenza di personale numeroso.
L’esperto responsabile della qualità riconoscerà i parallelismi con la norma ISO 9001:2015. La norma rivista richiede che un laboratorio di prova accreditato risponda in modo continuo e dimostrabile ai requisiti delle parti interessate. Oltre ai pazienti e alle strutture sanitarie, le parti interessate includono il pubblico, i legislatori e altre parti interessate che ogni laboratorio di test deve identificare da solo.
La sezione 6.2 “Personnel” è incentrata sui requisiti di competenza e sulle esigenze di formazione continua e sviluppo professionale:
a) il laboratorio specifica i requisiti di competenza per ciascuna funzione che influiscono sui risultati delle attività di laboratorio, compresi i requisiti in materia di istruzione, qualificazione, formazione, riqualificazione, conoscenze tecniche, competenze ed esperienza;
b) il laboratorio garantisce che tutto il personale abbia la competenza per svolgere le attività di laboratorio di cui è responsabile;
c) il laboratorio deve disporre di un processo per la gestione della competenza del proprio personale, che comprenda requisiti per la frequenza della valutazione delle competenze;
d) il laboratorio deve disporre di informazioni documentate che dimostrino la competenza del proprio personale.
Il personale che partecipa ai processi manageriali e tecnici dispone di un programma di formazione continua. Tutto il personale partecipa alla formazione continua e al regolare sviluppo professionale o ad altre attività di collegamento professionale. L’adeguatezza dei programmi e delle attività è riesaminata periodicamente.
La norma sottolinea la necessità di includere le informazioni che riguardano la selezione, la supervisione e il monitoraggio continuo. Il laboratorio deve disporre di procedure per:
a) determinare i requisiti di competenza specificati al 6.2.2 a);
b) descrizioni delle posizioni;
c) formazione e riqualificazione;
d) autorizzazione del personale;
e) controllo della competenza del personale
BD può rappresentare un valido supporto per i laboratori che non hanno ancora ottimizzato le attività e il tracciamento, grazie ai servizi di formazione, sia in presenza che a distanza, e ai fondamentali servizi di mappatura e monitoraggio di tutte le attività formative intraprese.
Sicurezza dei dati
L’attuale documento ISO 15189 richiede requisiti ancora più rigorosi per la protezione del dato e per la sicurezza dei sistemi informatici al fine di garantire la sicurezza del dato sensibile sia per i pazienti che per gli operatori. Vediamo le nuove indicazioni nella sezione 8.3 “Control of management system documents”, relativa al controllo dei documenti dei sistemi di gestione.
Il laboratorio controlla i documenti (interni ed esterni) relativi all’adempimento del presente documento. Il laboratorio deve assicurare che:
a) i documenti siano identificati in modo univoco;
b) i documenti siano approvati per l’adeguatezza prima del rilascio da personale autorizzato che disponga delle competenze e delle competenze necessarie per determinare l’adeguatezza;
c) i documenti siano periodicamente riesaminati e aggiornati, se necessario;
d) le versioni pertinenti dei documenti applicabili siano disponibili presso i punti di utilizzo e, se necessario, la loro distribuzione sia controllata;
e) siano identificate le modifiche e l’attuale stato di revisione dei documenti;
f) i documenti siano protetti da modifiche non autorizzate e da qualsiasi cancellazione o rimozione.
g) i documenti siano protetti da accessi non autorizzati;
h) sia impedito l’uso involontario di documenti obsoleti e sia applicata un’adeguata identificazione se conservati per qualsiasi scopo;
i) almeno una copia cartacea o elettronica di ciascun documento controllato obsoleto sia conservata per un determinato periodo di tempo o conformemente ai requisiti specifici applicabili.
Creazione di record
Il laboratorio stabilisce e conserva registrazioni leggibili per dimostrare il rispetto dei requisiti del presente documento. Al momento dell’esecuzione di ciascuna attività che influisce sulla qualità di un’analisi, devono essere creati dei registri.
Modifica dei registri
Il laboratorio deve garantire che le modifiche apportate alle registrazioni siano riconducibili a versioni precedenti o a osservazioni originali. I dati e gli archivi originali e modificati sono conservati, compresa la data e, se disponibile, l’ora, l’ora della modifica, l’indicazione degli aspetti modificati e il personale che effettua le modifiche.
Conservazione delle registrazioni
a) Il laboratorio deve applicare le procedure necessarie per l’identificazione, la conservazione, la protezione da accessi e modifiche non autorizzati, il backup, l’archiviazione, il recupero, il tempo di conservazione e lo smaltimento dei suoi registri.
b) Devono essere specificati i tempi di conservazione delle registrazioni.
c) I risultati degli esami riportati devono essere reperibili per tutto il tempo necessario o come richiesto.
d) Tutte le registrazioni devono essere accessibili per l’intero periodo di conservazione, leggibili su qualsiasi supporto in cui il laboratorio conservi le registrazioni e disponibili per la revisione della gestione del laboratorio.
Gli strumenti digitali di BD per la raccolta e la conservazione dei dati sensibili permettono di ridurre il rischio di perdita o diffusione del dato. Assicurano l’accessibilità e la leggibilità su diversi supporti.
Identificazione e controllo delle non conformità
Oggi al laboratorio è richiesta la capacità di identificare e gestire le non conformità mediante una procedura dedicata che esplori tutte le fasi del processo. La procedura deve prevedere azioni immediate da intraprendere in caso di non conformità. I prodotti BD e le eventuali criticità associate vengono gestite da personale dedicato ed esperto di aspetti normativi, sempre pronto a supportare i laboratori in caso di non conformità emergenti.
Nella sezione 8.7 “Nonconformities and corrective actions” vediamo i requisiti per la gestione delle non conformità e le azioni correttive. In caso di non conformità, il laboratorio dovrà:
a) rispondere alla non conformità e nel caso:
1) adottare misure immediate per controllare e correggere la non conformità.
2) affrontare le conseguenze, con particolare attenzione alla sicurezza dei pazienti, compresa l’escalation verso la persona appropriata.
b) Determinare la causa(e) della non conformità.
c) Valutare la necessità di un’azione correttiva per eliminare la causa(e) della non conformità, al fine di ridurre la probabilità che si verifichi ancora o che accada in altri contesti, mediante:
1) revisione e analisi della non conformità.
2) determinazione dell’esistenza o del potenziale verificarsi di simili non conformità.
3) valutazione del rischio(i) potenziale e dell’effetto(i) del ripresentarsi della non conformità.
d) Attuare delle azioni necessarie.
e) Esaminare e valutare l’efficacia delle eventuali azioni correttive adottate.
f) Aggiornare i rischi e le opportunità di miglioramento, se necessario.
g) Effettuare modifiche al sistema di gestione, se necessario.
Le azioni correttive sono adeguate agli effetti delle non conformità riscontrate e attenuano la causa(e) individuata.
Il laboratorio conserva le registrazioni come prova di:
a) natura delle non conformità, causa (cause) e delle azioni successive adottate, e
b) valutazione dell’efficacia di qualsiasi azione correttiva.
Gestione del rischio
Lo standard ISO 15189-2022 introduce norme più restrittive sulla gestione del rischio, che è in linea con i requisiti normativi della norma ISO 22367:2020.
La pianificazione, l’attuazione e la dimostrazione dell’efficacia delle misure adottate per attenuare i rischi potenziali hanno lo scopo di ridurre i rischi potenziali per paziente, operatori e terzi. Il tema della gestione dei rischi è essenziale anche per le azioni correttive e preventive.
Il tema della gestione dei rischi e delle opportunità ha una sezione dedicata (8.5), a differenza dello standard precedente in cui tale argomento era trattato in modo più superficiale nella sezione 4.11 “Misure preventive”.
Vediamo le novità presenti nella sezione 8.5 “Actions to address risks and opportunities for improvement”. Il laboratorio individua i rischi e le opportunità di miglioramento associati alle attività di laboratorio al fine di:
a) prevenire o ridurre gli impatti indesiderati e i potenziali danni nelle attività di laboratorio.
b) migliorare, agendo sulle opportunità.
c) assicurare che il sistema di gestione raggiunga i risultati previsti.
d) ridurre i rischi per la cura dei pazienti.
e) contribuire al raggiungimento dello scopo e degli obiettivi del laboratorio.
Il laboratorio dà la priorità e agisce in base ai rischi individuati. Le misure adottate per affrontare i rischi sono proporzionali al potenziale impatto sui risultati delle analisi di laboratorio, nonché sulla sicurezza dei pazienti e del personale. Registra le decisioni prese e le azioni intraprese in merito ai rischi e alle opportunità. Integra e attua azioni sui rischi individuati e sulle opportunità di miglioramento nel suo sistema di gestione e ne valuta l’efficacia
Gestione delle emergenze
Nella sezione 7.8 “Continuity and emergency preparedness planning” troviamo le novità relative alla gestione delle emergenze in termini di pianificazione della continuità e preparazione all’emergenza.
Il laboratorio garantisce che siano stati identificati i rischi associati a situazioni di emergenza o ad altre condizioni in cui le attività di laboratorio sono limitate o non disponibili e che esista una strategia coordinata che preveda piani, procedure e misure tecniche per consentire il proseguimento delle operazioni dopo un’interruzione.
I piani sono sottoposti a prove periodiche e la capacità di risposta prevista è esercitata, ove possibile. Il laboratorio deve:
a) stabilire una risposta pianificata alle situazioni di emergenza, tenendo conto delle esigenze e delle capacità di tutto il personale di laboratorio interessato;
b) fornire informazioni e formazione adeguate al personale di laboratorio interessato;
c) rispondere a situazioni di emergenza reali;
d) adottare misure per prevenire o attenuare le conseguenze di situazioni di emergenza, adeguate all’entità dell’emergenza e al potenziale impatto.
Sostenibilità e impatto ambientale dei processi
Il tema della sostenibilità dei processi e l’impatto degli stessi sul nostro ambiente sono requisiti imprescindibili ormai per tutte le realtà aziendali. Anche la norma ISO 15189 sottolinea l’importanza di effettuare una valutazione e del raggiungimento di alcuni standard anche nei processi diagnostici. BD, grazie all’utilizzo di materiali bio-compatibili e processi ecosostenibili , aiuta a ridurre l’impatto del laboratorio e al raggiungimento dei parametri stringenti oggi richiesti.
Globalmente, BD rappresenta un valido supporto per i laboratori che intendono allineare i propri standard qualitativi ai requisiti della norma ISO 15189:2022. Grazie ai servizi informatizzati e strumentali, alla formazione di elevata qualità, ai sistemi di tracciabilità e di gestione della qualità, BD può semplificare e velocizzare l’adeguamento dei laboratori di patologia clinica e di microbiologia ai fini dell’accreditamento entro i tempi stabiliti.
Tutto ciò, attraverso un’ampia gamma di soluzioni e servizi:
• servizi e forniture: fornendo soluzioni per il trattamento e la conservazione dei campioni ematici di qualità;
• identificazione e controllo delle non-conformità: attraverso l’ufficio Post Market Quality di BD Italia, con l’ausilio di personale esperto interamente dedicato;
• azioni preventive e miglioramento continuo: attraverso servizi di formazione continuativa (es. FAD, piattaforme e.learning ecc.);
• istruzioni d’uso: attraverso documentazione e bibliografia;
• addestramento e valutazione delle competenze: attraverso l’implementazione di un approccio standardizzato e strutturato (con servizi professionali quali ad es. PAQC, DREAM etc.) BD con la sua divisione Integrated Diagnostic Solution – IDS può supportare nell’individuazione sia delle cause alla base degli errori preanalitici sia delle soluzioni per migliorare il flusso di lavoro e l’efficienza. Quindi pianificare attività di formazione e addestramento adeguati.
HAI BISOGNO DI MAGGIORE SUPPORTO SU QUESTA TEMATICA? CONTATTACI
BD-110170
Referenze
1. Banca Dati Accredia – Sito web https://services.accredia.it/
• Laura Sciacovelli, Ada Aita, Andrea Padoan, Mario Plebani. Gli indicatori di qualità nel processo di armonizzazione in Medicina di Laboratorio. Biochimica Clinica, 2015, 39(6): 601.
• INTERNATIONAL STANDARD ISO 15189 Medical laboratories — Requirements for quality and competence. Fourth edition 2022-12
• Ilinca R, et al. Understanding the key differences between ISO 15189:2022 and ISO 15189:2012 for an improved medical laboratory quality of service. Revista Română de Medicină de Laborator 2023;31(2):77-82
• NATA Specific Accreditation Guidance ISO 15189:2022 Gap analysis March 2023
• Medical laboratories: ISO 15189:2022 – What’s new? (https://www.metecon.de/en/news/iso-15189-2022-was-ist-neu/u/1143/?n=4)
• Shirn A. Changes in the New ISO 15189:2022 December 16, 2022 American National Standard Institute. (https://blog.ansi.org/anab/changes-in-the-new-iso-15189-2022/
TORNA ALLE NEWS

 Le diagnosi convenzionali di infezioni gastrointestinali enteriche si basano su tre tecniche principali: esame microscopico (parassiti), coltura su piastra associato a test di sensibilità agli antibiotici (AST) e rilevamento dell’antigene mediante test immunologici.
Le diagnosi convenzionali di infezioni gastrointestinali enteriche si basano su tre tecniche principali: esame microscopico (parassiti), coltura su piastra associato a test di sensibilità agli antibiotici (AST) e rilevamento dell’antigene mediante test immunologici.

 BD Vacutainer® offre una gamma completa di dispositivi di sicurezza di ultima generazione e un accreditato programma di informazione e formazione sulla prevenzione nelle punture accidentali e sul rischio di esposizione ad agenti patogeni.
BD Vacutainer® offre una gamma completa di dispositivi di sicurezza di ultima generazione e un accreditato programma di informazione e formazione sulla prevenzione nelle punture accidentali e sul rischio di esposizione ad agenti patogeni.

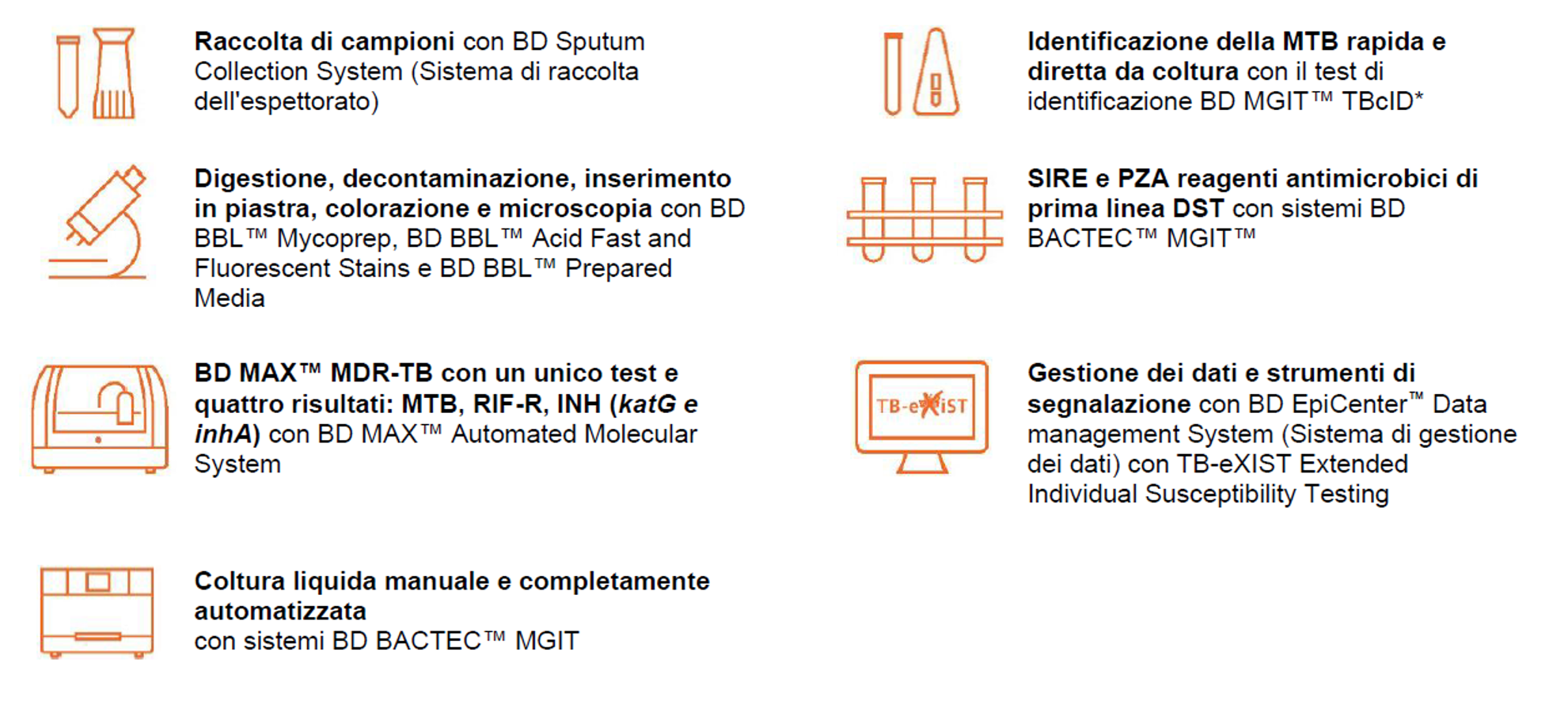
 Si ritiene che nei prossimi 35 anni la MDR-TB costerà all’economia globale 16,7 trilioni di dollari.5 Se le tendenze attuali continueranno, la MDR-TB potrebbe uccidere circa 75 milioni di persone in tutto il mondo entro il 2050.5 Se non tenuta sotto controllo, i modelli hanno stimato che nel tempo la percentuale di tubercolosi resistente ai farmaci continuerà ad aumentare e diventerà più difficile e più costosa da trattare.5
Si ritiene che nei prossimi 35 anni la MDR-TB costerà all’economia globale 16,7 trilioni di dollari.5 Se le tendenze attuali continueranno, la MDR-TB potrebbe uccidere circa 75 milioni di persone in tutto il mondo entro il 2050.5 Se non tenuta sotto controllo, i modelli hanno stimato che nel tempo la percentuale di tubercolosi resistente ai farmaci continuerà ad aumentare e diventerà più difficile e più costosa da trattare.5