Le tecniche di screening molecolare per organismi multiresistenti ai farmaci (MDRO) possono ridurre i tassi di mortalità e l’onere economico della resistenza antimicrobica (AMR)
Gli organismi multiresistenti (MDRO) sono microrganismi, principalmente batteri, che diventano resistenti a causa dell’uso improprio di antibiotici, nonché attraverso mutazioni naturali.1 Esistono evidenze secondo cui la resistenza antimicrobica (AMR) sia una delle maggiori minacce per la salute globale , sicurezza alimentare e sviluppo nella società odierna.1 L’AMR non solo impedisce il trattamento di malattie infettive, come la polmonite, ma secondo l’Organizzazione mondiale della sanità (OMS) mette a rischio anche i risultati della medicina moderna, poiché gli interventi chirurgici diventano molto più pericolosi senza antibiotici efficaci.1
Un rapporto di sorveglianza europeo pubblicato nel 2020, basato sui dati per il periodo 2015-2019, ha mostrato che i paesi europei avevano fino al 46,7% di isolati invasivi di Staphylococcus aureus resistenti alla meticillina (MRSA).2 Sono stati riscontrati anche tassi particolarmente elevati di resistenza ai carbapenemi, specie in alcuni Paesi tra cui Grecia, Italia e Bulgaria (Tabella 1).2
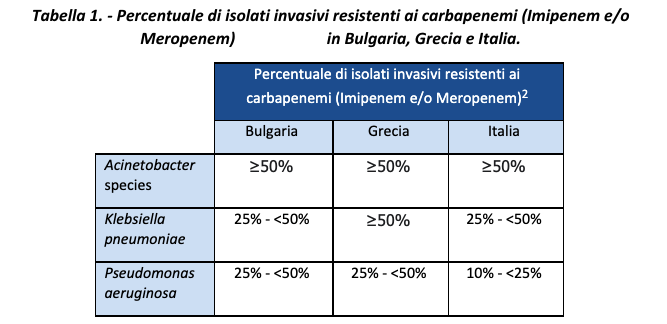
Tra il 2015 e il 2019, in vari Paesi europei come Irlanda, Germania, Romania, Ungheria, Grecia, Lettonia, Croazia, Lituania, Polonia e Slovacchia, è stato osservato un aumento significativo anche degli Enterococchi resistenti alla vancomicina (VRE) con 25-50 % di isolati invasivi con resistenza.2 Nonostante la Norvegia abbia una delle percentuali più basse di AMR nelle infezioni del sangue, la resistenza agli antibiotici ad ampio spettro – usati per combattere gli MDRO – è aumentata negli ultimi 10 anni.3 Guardando in particolare alla situazione Italiana, i risultati della sorveglianza nazionale AR-ISS pubblicati a fine 2021 sui i dati raccolti nel 2020 – in piena emergenza COVID-19 – hanno mostrato ancora elevate percentuali di resistenza alle principali classi di antibiotici per gli 8 patogeni sotto sorveglianza, con particolare preoccupazione per MRSA si è mantenuta stabile, intorno al 34%) ed Enterococcus faecium (cresce la percentuale di isolati resistenti alla vancomicina, fino a 23,6%).4
L’aumento della prevalenza MDRO in tutta Europa richiede, quindi, un intervento efficace per ridurre il carico sociale. Sulla prevalenza degli MDRO influiscono diversi fattori di rischio, alcuni emersi di recente, che hanno un vasto impatto sui sistemi sanitari e sulle comunità europee. Questo impatto negativo è probabilmente dovuto anche alle carenze delle attuali tecniche di screening, che si traducono in una mancanza di rilevamento e controllo della resistenza antimicrobica.
Fattori di rischio per MDRO in Europa
Il fattore di rischio più noto per la resistenza antimicrobica è l‘abuso di antibiotici; a livello globale, si verifica una grande quantità di automedicazione antibiotica a causa dell’accesso “da banco”. Secondo il Centro europeo per la prevenzione delle malattie (ECDC) e l’OMS, la Grecia ha mostrato una dose giornaliera definita (DDD) più alta di uso di antibiotici in Europa e un aumento del consumo del 2,4% tra il 2014 e il 2018, mentre molti Paesi europei hanno assistito a una diminuzione.4 Questo, associato agli alti livelli di resistenza agli antibiotici in Grecia, suggerisce un nesso causale.2
D’altra parte, l’Italia – Paese con livelli elevati di resistenza agli antibiotici – ha mostrato una DDD relativamente bassa, suggerendo il coinvolgimento di fattori aggiuntivi. Nuovi ceppi di MRSA sono stati rilevati in Europa nel 2021; in particolare, il clone t304/ST6 è stato identificato in cinque paesi dell’Europa settentrionale come originario del Medio Oriente.6 Inoltre, uno studio su richiedenti asilo e rifugiati ammessi all’ospedale universitario di Helsinki tra il 2010 e il 2017 ha rilevato che il 45% è stato colonizzato da MDRO e Il 12,5% aveva due o più ceppi di MDRO rilevabili.7 La percentuale di portatori di MDRO era maggiore tra i pazienti dell’Iraq (57,2%), della Siria (55,8%), dell’Afghanistan (34,8%) e della Somalia (25,8%).7 Le migrazioni di massa dai Paesi a basso e medio reddito del Medio Oriente e dell’Africa è prevalente nella società odierna, con l’Europa che ha ricevuto 9,2 milioni di domande di asilo tra il 2010 e il 2019.8 Secondo la Commissione Europea, Italia e Grecia sono tra i paesi europei con il maggior numero di domande di asilo per la prima volta.9
Uno studio recente ha anche riscontrato un’associazione tra MRSA e cambiamento climatico, suggerendo che un aumento di 1°C della temperatura media potrebbe comportare un aumento di 1,02 volte.10 Sembra esserci un’associazione tra la temperatura media della stagione calda e rilevazione di MRSA, con un coefficiente di correlazione di 0,826.10 Inoltre, si stima che la prevalenza di Pseudomonas aeruginosa resistente ai carbapenemi (CRPA) raddoppierà nel Regno Unito e nei Paesi Bassi entro il 2039 e aumenterà del 70% in Danimarca a causa del solo cambiamento climatico.11 Un altro studio negli Stati Uniti ha rilevato che un aumento di 10°C della temperatura tra le regioni ha provocato un aumento della resistenza agli antibiotici del 4,2%, 2,2% e 2,7% per Escherichia coli, Klebsiella pneumoniae e Staphylococcus aureus; questo aumento è stato anche associato a una maggiore densità di popolazione, suggerendo che la crescita della resistenza antimicrobica non dovrebbe essere sottovalutata nelle popolazioni attualmente in crescita.11
Impatto dell’AMR sui Paesi europei e azioni di contrasto previste in Italia.
La mancanza di un intervento sufficiente per combattere gli MDRO potrebbe portare a un aumento del 72% della resistenza agli antibiotici di seconda linea entro il 2030 nell’UE/SEE ed è probabile che la resistenza agli antibiotici di ultima linea raddoppi.12 Ciò ha gravi implicazioni per i Paesi europei, poiché le infezioni determinano un aumento della durata delle degenze ospedaliere, un aumento dei tassi di resistenza agli antimicrobici, costi medici più elevati e un aumento della mortalità.13
Laddove gli antibiotici di prima linea non possono più essere utilizzati, è spesso necessario l’impiego di farmaci più costosi, comportando un maggiore onere economico per le famiglie e per tutta la società.1 Nel 2019, l’AMR e il suo trattamento inefficace sono costati 1,1 miliardi di euro ai sistemi sanitari dell’UE/Paesi SEE.12 In modo preoccupante, nel 2019, i decessi in Europa dovuti alla resistenza antimicrobica sono aumentati a 33.000.12 Una rapida valutazione del rischio per le Enterobacteriaceae resistenti ai carbapenemi (CRE) nel 2018 ha suggerito che indagini di laboratorio e segnalazioni tempestive e appropriate sono essenziali per evitare ritardi nel trattamento appropriato e minimizzare il rischio di morte associato.15
In Italia, il nuovo Piano Nazionale di Contrasto all’Antibiotico-Resistenza (PNCAR) 2022-2025, redatto dal Ministero della Salute e recentemente pubblicato16, si articola su tre filoni principali di azione che prevedono un approccio multidisciplinare e One Health (principale elemento di innovazione rispetto ai piani precedenti):
- sorveglianza e monitoraggio integrato dell’AMR, dell’utilizzo di antibiotici, delle infezioni correlate all’assistenza (ICA) e monitoraggio ambientale;
- prevenzione delle ICA in ambito ospedaliero e comunitario e delle malattie infettive e zoonosi;
- uso appropriato degli antibiotici sia in ambito umano che veterinario e corretta gestione e smaltimento degli antibiotici e dei materiali contaminati.
Tra gli obiettivi nell’ambito della sorveglianza/monitoraggio dell’AMR c’è ad esempio il rafforzamento della sorveglianza CRE, promuovendo l’uso di metodiche molecolari. L’importanza di una sorveglianza degli MDRO a livello nazionale era da tempo sotto esame ed era stata ripresa come necessità anche dal gruppo di lavoro GLISTer di AMCLI in un articolo del 2017, con focus su Residenze Sanitarie Assistite e Strutture Territoriali Assimilabili, identificando anche tre diversi livelli di sorveglianza possibili.
Le tecniche molecolari come complemento alle tecniche colturali classiche
Tradizionalmente, lo screening per la resistenza antimicrobica utilizza tecniche di coltura su piastra, per le quali il processo di ottenimento del risultato (TAT) – dall’inizio alla fine – può richiedere fino a cinque giorni.18 Aspettare così tanto tempo per l’identificazione può portare a ritardi nell’attuazione di adeguate misure di controllo delle infezioni, portando potenzialmente a un’ulteriore trasmissione e mutazioni. Un’identificazione ritardata può portare anche a ritardi nell’avvio di un trattamento appropriato, che può anche contribuire alla resistenza batterica e potrebbe essere dannoso per la salute del paziente o addirittura rivelarsi fatale.
Uno studio ha osservato che quando si confronta specificamente il rilevamento di S. aureus sensibile alla meticillina (MSSA) e MRSA utilizzando tecniche di coltura rispetto a un test PCR, il rilevamento è costantemente sottostimato. Per i metodi di coltura, la semina diretta ha rilevato il 22,4% di MSSA e l’1,2% di MRSA nei campioni rispetto al 35,6% di MSSA e al 2,3% di MRSA utilizzando un test PCR.19 Nello stesso studio, hanno modellato questi risultati sui dati della sorveglianza nazionale e hanno stimato che circa 5.000-8.000 infezioni del sito chirurgico di S. aureus potrebbero essere prevenute utilizzando metodi di screening molecolare. Nel solo Regno Unito, ciò potrebbe far risparmiare da £ 17 milioni a £ 130 milioni all’anno in costi di trattamento.19
Ci sono diverse problematiche (e le loro implicazioni) nella ricerca e nello sviluppo di un efficace test di screening per MDRO. La diagnostica molecolare per MDRO può essere utile come secondo step per confermare i test colturali fenotipici e nella sorveglianza, ad esempio, per confermare i meccanismi responsabili di determinate resistenze20. Tuttavia, si ritiene che i metodi colturali sottovalutino notevolmente il numero di MDRO all’interno di un campione e tali falsi negativi devono essere ridotti al minimo per ridurre l’impatto sui sistemi sanitari. Ciò suggerisce un uso dei test molecolari come primo step, ma sebbene forniscano informazioni importanti e clinicamente rilevanti, hanno a loro volta limiti: infatti, i test molecolari sono più sensibili dei colturali, ma rilevano solo i geni o le mutazioni di resistenza noti e il test di resistenza fenotipica (esame colturale) è sempre necessario nella sorveglianza – in caso di risultato positivo – per garantire la corretta classificazione degli isolati batterici20. In ogni caso, ne deriva che la diagnostica molecolare e fenotipica degli MDRO si completano a vicenda per migliorare la comprensione sia dell’entità della resistenza in un determinato contesto che dei meccanismi sottostanti responsabili della resistenza20.
L’impegno e le soluzioni di BD
BD è quotidianamente al fianco degli operatori sanitari di tutto il mondo nella lotta all’AMR. BD si impegna ad aiutare a rallentare la diffusione della resistenza agli antibiotici migliorando la consapevolezza, la sorveglianza, la prevenzione delle infezioni e la gestione dei pazienti.
Offriamo un’ampia gamma di soluzioni utilizzabili per prevenire la diffusione delle infezioni nelle strutture sanitarie, sistemi diagnostici per il monitoraggio e la diagnosi di infezioni correlate all’assistenza (ICA), compresi i ceppi resistenti ai farmaci, e funzionalità di sorveglianza e reportistica all’avanguardia per monitorare e prevedere i focolai di MDRO.
In particolare:
- la gamma di test molecolari validati per il sistema totalmente automatizzato BD MAX™ per il monitoraggio delle ICA e i principali MDRO (compreso MDR-TB) garantisce un rilevamento precoce e accurato che, associato a un adeguato trattamento antimicrobico, può prevenire la trasmissione e migliorare la gestione del paziente. Scopri maggiori dettagli su test molecolari disponibili per CPO, MRSA, VRE e Cdiff. [Link alla brochure ICA Biologia Molecolare/Materiale informativo di BD Academy]
- soluzioni per le analisi colturali e fenotipiche (manuali ed automatizzate), tra cui il sistema BD Phoenix™ M50 ed i relativi pannelli, associato al BD Bruker MALDI BioTyper® e al middlware BD Epicenter™ che garantisce risultati accurati ID/AST per la corretta classificazione del microrganismo e prescrizione degli antibiotici. Scopri maggiori dettagli QUI.
BD è partner a 360° nel flusso di lavoro per la sorveglianza degli MDRO. Approfondisci QUI l’impegno di BD per la lotta all’AMR e alle ICA.
BD-77376
Referenze
- World Health Organization. Antibiotic Resistance. 2020. Available at: https://www.who.int/news-room/fact-sheets/detail/antibiotic-resistance. Accessed: July 2021.
- European Centre for Disease Prevention and Control. Surveillance report. Antimicrobial resistance in the EU/EEA (EARS-Net). 2019. Available at: https://www.ecdc.europa.eu/en/publications-data/surveillance-antimicrobial-resistance-europe-2019. Accessed: July 2021.
- European Centre for Disease Prevention and Control. ECDC country visit to Norway to discuss antimicrobial resistance issues. ECDC. 2019. Available at: https://www.ecdc.europa.eu/sites/default/files/documents/antimicrobial-resistance-country-visit-norway.pdf. Accessed: July 2021.
- Epicentro – Report del Sistema di sorveglianza AR-ISS. Available at: https://www.epicentro.iss.it/antibiotico-resistenza/ar-iss/RIS-1_2021.pdf – Accessed: Oct 2022.
- Robertson J, Vlahović-Palčevski V, Iwamoto K, Högberg LD, Godman B, Monnet DL, Garner S, Weist K, Strauss R, Vandael E, and Ivanov IN. Variations in the Consumption of Antimicrobial Medicines in the European Region, 2014–2018: Findings and Implications from ESAC-Net and WHO Europe. Front Pharmacol. 2021;12:639207.
- Bartels MD, Worning P, Andersen LP, Bes M, Enger H, Ås CG, Hansen TA, Holzknecht BJ, Larssen KW, Laurent F, and Mäkitalo B. Repeated introduction and spread of the MRSA clone t304/ST6 in northern Europe. Clin Microbiol Infect. 2021;27(2):284.e1-284.e4.
- Aro T and Kantele A. High rates of meticillin-resistant Staphylococcus aureus among asylum seekers and refugees admitted to Helsinki University Hospital, 2010 to 2017. Euro Surveill. 2018;23(45):1700797.
- United Nations High Commissioner for Refugees. Global trends: Forced Displacement in 2019. 2019. Available at: https://www.unhcr.org/5ee200e37.pdf. Accessed: July 2021.
- European Commission. Overall figures of immigrants in European society. 2020. Available at: https://ec.europa.eu/info/strategy/priorities-2019-2024/promoting-our-european-way-life/statistics-migration-europe_en. Accessed: July 2021.
- Kaba HE, Kuhlmann E, and Scheithauer S. Thinking outside the box: association of antimicrobial resistance with climate warming in Europe–a 30 country observational study. Int J Hyg Environ Health. 2020;223(1):151-158.
- MacFadden DR, McGough SF, Fisman D, Santillana M, and Brownstein JS. Antibiotic resistance increases with local temperature. Nat Clim Change. 2018;8(6):510-514.
- European Centre for Disease Prevention and Control. and Organisation for Economic Cooperation and Development. Antimicrobial Resistance: Tackling the Burden in the European Union. 2019; pp.3. Available at: https://www.oecd.org/health/health-systems/AMR-Tackling-the-Burden-in-the-EU-OECD-ECDC-Briefing-Note-2019.pdf. Accessed: July 2021.
- Váradi L, Luo JL, Hibbs DE, Perry JD, Anderson RJ, Orenga S, and Groundwater PW. Methods for the detection and identification of pathogenic bacteria: past, present, and future. Chem Soc Rev. 2017;46(16):4818-4832.
- European Centre for Disease Prevention and Control and the European Medicines Agency. The bacterial challenge: time to react. A call to narrow the gap between multidrug-resistant bacteria in the EU and the development of new antibacterial agents. Available at: https://www.ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/0909_TER_The_Bacterial_Challenge_Time_to_React.pdf. Accessed: July 2021.
- European Centre for Disease Prevention and Control. Rapid Risk Assessment: Carbapenem-resistant Enterobacteriaceae – first update. 2018. Available at: https://www.ecdc.europa.eu/sites/default/files/documents/RRA-Enterobacteriaceae-Carbapenems-European-Union-countries.pdf. Accessed: July 2021.
- Redazione Aboutpharma. Antibioticoresistenza: il nuovo Piano nazionale 2022-25 è all’esame delle Regioni. 21 Settembre 2022. https://www.aboutpharma.com/animal-health/antibioticoresistenza-il-nuovo-piano-nazionale-2022-25-e-allesame-delle-regioni/
- Aschbacher, R., Pagani, L., Migliavacca, R. et al. Recommendations for the surveillance of multidrug-resistant bacteria in Italian long-term care facilities by the GLISTer working group of the Italian Association of Clinical Microbiologists (AMCLI). Antimicrob Resist Infect Control 9, 106 (2020). https://doi.org/10.1186/s13756-020-00771-0
- Scerbo MH, Kaplan HB, Dua A, Litwin DB, Ambrose CG, Moore LJ, Murray CCK, Wade CE, and Holcomb JB. Beyond blood culture and gram stain analysis: a review of molecular techniques for the early detection of bacteremia in surgical patients. Surg Infect (Larchmt). 2016;17(3):294-302.
- Tsang STJ, McHugh MP, Guerendiain D, Gwynne P, Boyd J, Walsh TS, Laurenson IF, Templeton KE, and Simpson AHRW. Underestimation of Staphylococcus aureus carriage associated with standard culturing techniques. Bone Joint Res. 2018;7(1):79-84.
- Global Antimicrobial Resistance Surveillance System (GLASS). Molecular methods for antimicrobial resistance (AMR) diagnostics to enhance the Global Antimicrobial Resistance Surveillance System. Geneva: World Health Organization; 2019 (WHO/WSI/AMR/2019.1). Licence: CC BY-NC-SA 3.0 IGO. https://www.who.int/publications/i/item/WHO-WSI-AMR-2019.1
