16 previsioni per i laboratori clinici per il 2024
Di Chris Wolsky – Per leggere l’articolo originale, visitare il sito di CLP: https://clpmag.com/diagnostic-technologies/16-clinical-laboratory-predictions-for-2024/
CLP ha recentemente chiesto agli esperti del settore dei laboratori clinici di valutare le loro previsioni per il 2024. Di seguito, in nessun ordine particolare, trovate le prime 16 previsioni.
#1 – La carenza di personale continuerà nonostante la spinta verso salari elevati
Non è un segreto che i laboratori clinici si trovino ad affrontare significative carenze di personale, in parte a causa della domanda esponenziale di test di laboratorio.
In qualità di membro del comitato consultivo editoriale (EAB) del CLP, Rachele Moore, MBA, MLS (ASCP), osserva che la domanda non è l’unica ragione per cui stiamo affrontando una carenza di nuovi laboratoristi, e la soluzione non è così semplice come investire denaro.
“I laboratori sono attualmente alle prese con una grave carenza di professionisti dei laboratori medici a causa di vari fattori come la chiusura dei programmi di formazione, una diminuzione degli studenti richiedenti e vincoli finanziari“, afferma Moore, che è anche direttore esecutivo dei servizi di laboratorio per l’Aultman Health Foundation. “Per affrontare questa carenza, è essenziale che i laboratori lavorino per ottenere compensi competitivi, una cultura del lavoro positiva e opportunità di avanzamento di carriera. In questo modo, possono attrarre e trattenere personale qualificato per soddisfare la crescente domanda di test di laboratorio”.
E, sebbene un aumento dei compensi possa aiutare, Moore aggiunge che ci sono altre variabili da tenere in considerazione.
“Nonostante le sfide affrontate dai laboratori, c’è una crescente attenzione all’acquisizione e alla fidelizzazione dei talenti“, afferma. “Le organizzazioni riconoscono sempre più la necessità di offrire salari e benefit competitivi per attrarre persone qualificate. Ma affidarsi esclusivamente a salari elevati non è sufficiente. Creare un ambiente di lavoro positivo e opportunità di crescita professionale sono ugualmente cruciali per trattenere i talenti nel lungo termine”.
#2 – I laboratori clinici continueranno a puntare sull’uso dell’intelligenza artificiale, dell’apprendimento automatico e dei flussi di lavoro digitali
I laboratori clinici, come altri settori, hanno visto l’intelligenza artificiale, l’apprendimento automatico e i flussi di lavoro digitali cambiare ed evolvere il loro modo di fare affari. Nikos Pavlidis, presidente ad interim di BD Diagnostic Solutions, prevede che ciò continui anche nel 2024.
“Non c’è dubbio che l’automazione e l’informatica rimangono potenti motori nei laboratori clinici”, afferma. “Con la carenza di personale che continua a rappresentare una sfida per il settore, è fondamentale che i laboratori implementino automazione e processi dalla fase pre-analitica e alla reportistica dei risultati, supportati da flussi di lavoro interconnessi abilitati all’informatica, per migliorare l’efficienza e consentire ai laboratoristi di dedicare meno tempo a gravosi processi manuali e più tempo per compiti complessi.”
Pavlidis non è l’unico a vedere il 2024 come un anno sempre più digitale. Michelle MacPherson, direttrice della gestione dei prodotti ematologici per Beckman Coulter Diagnostics, prevede una trasformazione digitale in ematologia.
“Con l’alba della digitalizzazione delle immagini alle spalle, ora abbiamo le basi per accelerare plausibilmente la medicina di precisione utilizzando la morfologia cellulare per comprendere meglio la problematica, monitorare il trattamento e prevedere i risultati con una precisione significativamente maggiore”, afferma. “I test ematologici, vale a dire l’emocromo completo (CBC), sono parte integrante della valutazione medica e dell’iter diagnostico dei pazienti e, con meno di 100 µl di sangue, possiamo guidare il percorso diagnostico in malattie come la malaria, la leucemia e l’anemia . L’avvento dell’apprendimento automatico e del deep learning ci ha ora offerto l’opportunità di saperne di più sulla malattia e sulla terapia non solo digitalizzando tutte le informazioni ma anche combinandole con altri test e informazioni sui pazienti. Ciò porterà alla fine a una diagnosi più rapida, a trattamenti più efficaci e a una migliore gestione delle cure, il tutto con una provetta con il tappo lilla”.
#3 – Le offerte di laboratori clinici supporteranno la fornitura di assistenza sanitaria non tradizionale
La pandemia globale da COVID-19 ha cambiato molti aspetti della medicina, inclusa la crescente consapevolezza del valore dei test clinici. Ha anche dato inizio ad un’evoluzione nel modo in cui l’assistenza sanitaria è stata fornita ai pazienti.
Pavlidis prevede che i servizi di laboratorio si evolveranno per soddisfare la fornitura non tradizionale di cure mediche nel 2024. “Un’altra tendenza è la modernizzazione delle offerte di laboratorio per supportare l’evoluzione dell’erogazione dell’assistenza sanitaria condotta in luoghi non tradizionali (come a casa) o attraverso visite virtuali, nonché la necessità di aumentare l’accesso attraverso l’espansione dei programmi di sensibilizzazione“, afferma.
Brad Moore, presidente e CEO di Roche Diagnostics North America, vede la tendenza in un contesto più ampio, con il vantaggio di un migliore accesso alle cure. “Modalità di test nuove e innovative stanno avvicinando fisicamente la diagnostica al paziente. Ciò alla fine amplierà l’accesso alle cure e potenzialmente aiuterà a migliorare i risultati complessivi dei pazienti, in particolare in aree patologiche, come la salute sessuale, dove esistono disparità o stigmatizzazione”, afferma. “L’innovazione e la tecnologia continueranno ad essere importanti nella cura del diabete, l’area della diagnostica storicamente più vicina al paziente. Le persone con diabete apprezzano i moderni strumenti di gestione del diabete che alleviano lo stress e l’ansia legati alla loro condizione. Apprezzano la facilità d’uso, la precisione, l’affidabilità e il supporto per il monitoraggio dei dati di cui hanno bisogno ogni giorno per rimanere al passo con la gestione di tutto, dai carboidrati all’HbA1c.”
#4 – L’autoprelievo darà potere ai pazienti e migliorerà l’assistenza
Sebbene l’accesso sia un vero problema per molti pazienti, alcuni trovano difficile il processo di prelievo dei campioni per una serie di ragioni personali, culturali o logistiche. Pavlidis prevede che l’autoprelievo sarà un punto di svolta per i laboratori.
“La disponibilità dell’autoprelievo sarà un fattore abilitante significativo che consentirà ai laboratori di fornire servizi preziosi alla popolazione e di migliorare l’accesso; prendiamo come esempio l’autoprelievo dell’HPV”, afferma. “L’autoprelievo per il test HPV è già in uso in molti paesi del mondo. Sono in corso sforzi per portare questa opzione negli Stati Uniti e, se ci sarà un’approvazione tempestiva da parte della FDA, potremmo vedere – si spera di vedere – un aumento dello screening HPV, il che significa che più persone con una cervice trarranno vantaggio dalla comodità e dalla privacy della propria auto-raccolta di campione per effettuare uno screening critico. La Danimarca, ad esempio, ha visto un ulteriore 31% di donne precedentemente non sottoposte a screening partecipare al programma nazionale HPV del paese dopo che gli era stata offerta la possibilità di autoprelievo. Un maggior numero di test raccolti direttamente dal paziente destinati ai laboratori richiederà ai laboratori di sfruttare meglio la propria scala e capacità di ottimizzare le proprie prestazioni e standardizzare la qualità e i costi della diagnostica, dove ancora una volta l’automazione e l’informatica aiuteranno”.
#5 – La convergenza tra Life Science e Diagnostica diventa reale
La medicina standardizzata e valida per tutti sta finendo e assistiamo all’emergere di trattamenti personalizzati e su misura. Questa è la previsione di Yves Dubaquie, PhD, vicepresidente senior di Revvity. Ma questo è solo il primo passo verso la creazione di un ambiente sanitario più dinamico.
“Silos e lacune tecnologiche impediscono alla medicina personalizzata di raggiungere il suo massimo potenziale”, afferma. “Man mano che la scienza diventa più complessa e più personalizzata, vedremo una collaborazione ancora maggiore tra life science e diagnostica. Questa convergenza è fondamentale per contribuire a promuovere nuove scoperte scientifiche nei laboratori, portare un nuovo prodotto attraverso la clinica e, in definitiva, personalizzare una diagnostica unica che possa aiutare a identificare gli individui che trarranno il massimo beneficio da questa nuova terapia o cura. Questo “continuum” completo che coinvolge dalla ricerca allo sviluppo, dalla diagnosi alla cura, migliorerà l’assistenza sanitaria per tutti, ovunque”.
#6 – Il cambiamento climatico alimenterà la necessità di una nuova diagnostica
Il cambiamento climatico sta sicuramente influenzando molte discussioni sul futuro. Tyler Radke, MLS(ASCP)CM, collaboratore abituale del CLP, è tra coloro che vedono crescere nuove minacce alla nostra salute a causa del cambiamento climatico e di altri fattori.
“Continua ad esserci una battaglia in corso che si verifica lentamente nel tempo con lo sviluppo di resistenza nella Candida auris, Candida glabrata e Candida krusei, probabilmente a causa delle pressioni antifungine“, afferma. “Alcuni dei quali potrebbero essere dovuti a trattamenti migliorati e alla durata di vita prolungata dei pazienti immunocompromessi, creando un nuovo tipo di ambiente per lieviti e muffe opportunistici”.
E anche se è improbabile che vedremo un’epidemia apocalittica stile The Last of Us, la minaccia di infezioni fungine sta crescendo, afferma Radke.
“Un ottimo esempio della diffusione sempre più ampia delle muffe è un affascinante articolo della Washington University School of Medicine. Il team conclude che le muffe dimorfiche si trovano sempre più spesso in aree al di fuori della loro geografia storicamente endemica”, afferma. “Con titoli come questi, è difficile immaginare che le infezioni fungine non diventino un obiettivo più importante per la comunità dei laboratori. Con un po’ di fortuna, ciò porterà a metodi di test diagnostici avanzati che vanno oltre gli strumenti di cui disponiamo oggi, i quali presentano tutti limiti significativi in termini di velocità, complessità tecnica, sensibilità, specificità o costo. Si stanno facendo alcuni progressi con un test di nuova concezione per rilevare gli anticorpi contro Coccidioides spp.”.
Rodney E. Rohde, PhD, SM(ASCP)CM, SVCM, MBCM, FACSc, professore di Regents e membro globale del Medical Laboratory Science Program presso la Texas State University, prevede inoltre che sia le malattie infettive emergenti che quelle riemergenti “continueranno per amplificarsi di fronte ai continui cambiamenti climatici, geopolitici e di altro tipo”. Cita, in particolare, la resistenza antimicrobica come un problema globale continuo.
#7 – L’uso dei biomarcatori migliorerà la diagnosi di molteplici malattie
Ogni giorno sembra che vengano scoperti nuovi biomarcatori per una serie di malattie, che supportano la diagnosi precoce e trattamenti migliori e più efficaci. Aspettatevi di vederne di più, secondo Stephanie Franco, PhD, Senior Scientific Affairs Liaison per EUROIMMUN (parte di Revvity)
“Con l’entusiasmo che circonda l’approvazione di Leqembi da parte della FDA e l’approvazione in attesa di donanemab (trattamenti anti-amiloide per la malattia di Alzheimer (AD), riteniamo che ulteriori indagini cliniche sui biomarcatori ematici (BBBM) e sullo screening genetico siano indispensabili per promuovere miglioramenti nella diagnosi di AD e trattamenti“, afferma. “È stato dimostrato che i portatori di ApoE e4 corrono un rischio maggiore di sviluppare anomalie nell’imaging correlate all’amiloide (ARIA) quando vengono sottoposti a trattamenti anti-amiloide, come Leqembi e donanemab le istruzioni per l’uso di Leqembi per eseguire lo screening genetico dell’ApoE prima del trattamento, il che suggerisce che questo screening genetico potrebbe diventare un requisito per il trattamento. Inoltre, si sta studiando il valore di diversi biomarcatori nuovi ed esistenti nel plasma (ad esempio p-tau-217). diagnosi accurate e trattamenti più convenienti, facilmente accessibili e meno invasivi rispetto ai prelievi del liquido cerebrospinale e agli screening PET. Vediamo anche ulteriori indagini su terapie combinate con obiettivi diversi dall’amiloide per aiutare a ridurre il declino cognitivo nei pazienti con AD da lieve a moderata. Ulteriori esplorazioni dei BBBM e dei test genetici sull’ApoE saranno sicuramente cruciali nei prossimi capitoli della diagnosi e dei trattamenti dell’AD. Il panorama in evoluzione della ricerca sulla malattia di Alzheimer e dei dati degli studi clinici presentati alla più recente conferenza Clinical Trials for Alzheimer’s Disease (CTAD) è stato descritto come profondo e noi siamo d’accordo”.
Nel 2024, i laboratori e le istituzioni sanitarie stanno espandendo le proprie capacità interne per soddisfare la crescente domanda di test tramite immagini di scansione del liquido cerebrospinale e PET, gli unici metodi approvati dalla FDA attualmente disponibili per confermare la patologia amiloide, necessaria anche per le nuove terapie, secondo a Brad Moore di Roche.
Allo stesso modo, Moore ritiene che i biomarcatori aiutino a identificare e curare meglio le malattie oltre l’Alzheimer. “Ad esempio, l’American Diabetes Association (ADA) raccomanda che le persone con diabete siano sottoposte a una valutazione annuale del rischio per individuare precocemente l’insufficienza cardiaca, anche se al momento non presentano alcun sintomo“, afferma. “Le linee guida richiedono test per rilevare livelli elevati di peptide natriuretico di tipo B e/o livelli insoliti di troponina cardiaca ad alta sensibilità, che sono biomarcatori di malattie cardiovascolari sottostanti e possono essere elevati prima dello sviluppo dei sintomi”.
#8 – Test diagnostici innovativi per la tubercolosi saranno sviluppati come parte della strategia di eradicazione della malattia
Sebbene la tubercolosi sia una malattia prevenibile e curabile, continua a mietere innumerevoli vittime ogni anno, in particolare nei paesi a basso e medio reddito. Ruth Brignall, PhD, responsabile degli affari scientifici globali presso Revvity, prevede che nuovi tipi di test saranno fondamentali per sradicare la malattia.
“Gli attuali test diagnostici per la tubercolosi si basano sulla conferma microbiologica dei batteri della tubercolosi da campioni di espettorato o sui segni visivi della tubercolosi nel polmone osservati su una radiografia del torace. Di conseguenza, circa il 36% dei nuovi casi di tubercolosi, che non hanno tubercolosi polmonare o non possono produrre un campione di espettorato, non vengono diagnosticati o non segnalati. La sfida principale risiede nell’assenza di una diagnostica non basata sull’espettorato. Lo sviluppo di test accurati non basati sull’espettorato è fondamentale per diagnosticare individui affetti da tubercolosi attiva che non possono produrre espettorato”, afferma. “Nel 2024, prevediamo che lo sviluppo di strumenti diagnostici innovativi per la tubercolosi, come la diagnostica non basata sull’espettorato, inizierà ad affrontare le esigenze insoddisfatte nell’ambito della tubercolosi. Prevediamo inoltre che vedremo un migliore accesso ai test esistenti per una migliore copertura dove più necessario”.
#9 – Maggiore supervisione degli LDT da parte della FDA
La proposta della FDA di aumentare la supervisione dei test sviluppati in laboratorio (LDT) potrebbe avere profondi effetti sul settore dei laboratori clinici e sulla cura dei pazienti, prevede Ron Blum, PhD, membro del CLP EAB e Chief Science Officer di Sinai Labs.
“Nel 2022, il Congresso non è riuscito ad approvare l’atto VALID, una legislazione volta a spostare la supervisione degli LDT dalla CLIA alla FDA. A quel tempo, i funzionari della FDA hanno indicato che se la legge VALID non fosse passata, avrebbero pianificato la pubblicazione unilateralmente della propria proposta per regolamentare gli LDT”, afferma Blum. “Nella sua analisi, Bruce Quinn, MD, PhD, esperto di rimborsi e politiche sanitarie, identifica alcune sconcertanti stime dei costi che la FDA ritiene saranno necessarie per implementare la propria supervisione, per un importo di 50 miliardi di dollari. La FDA afferma di voler regolamentare gli LDT per migliorare la qualità dei test e la sicurezza dei pazienti, ma molti degli esempi citati come ragioni per implementare la supervisione non sono corretti. Gli LDT hanno svolto un ruolo vitale nel colmare le lacune critiche nell’assistenza sanitaria per i test sulle popolazioni svantaggiate, in particolare nel cancro, nella genetica e nelle malattie infettive, e costringere i laboratori a presentare i loro nuovi test attraverso il processo della FDA soffocherebbe l’innovazione e danneggerebbe effettivamente coloro che la FDA sostiene che una supervisione più rigorosa trarrebbe beneficio”.
#10 – La stratificazione del rischio per la prognosi diventerà uno strumento di supporto per i pazienti con malattie croniche
Per i pazienti con patologie croniche, una migliore comprensione della progressione della malattia prenderà probabilmente la forma di nuovi tipi di test, secondo Sharon Bracken, responsabile della diagnostica per Siemens Healthineers.
“C’è un’area di opportunità all’interno di ogni stato patologico per supportare i pazienti nelle prime fasi della diagnosi, per prevenire idealmente il progresso della malattia”, afferma. “Fino a quando non verranno rivelati o stabiliti nuovi biomarcatori per supportare lo sviluppo di test in grado di diagnosticare precocemente la malattia, l’attenzione, parallelamente, sarà focalizzata su opportunità più immediate per supportare la cura del paziente attraverso la prognosi e la stratificazione del rischio dei pazienti che sono a maggior rischio di progressione”. agli stadi più avanzati della malattia. L’identificazione di questi pazienti può supportare un monitoraggio più efficiente della progressione della malattia e anche una somministrazione o una modifica più precoce del trattamento. Possiamo anticipare che questi strumenti di intervento precoce assumeranno la forma di test e algoritmi di intelligenza artificiale e sono ormai all’orizzonte. Il più grande ostacolo all’utilizzo di questi nuovi strumenti al massimo potenziale sarà l’accessibilità di diversi set di dati che rappresentano scenari del mondo reale”.
#11 – I test per la malattia minima residua (MRD) diventeranno uno standard di cura in oncologia
Secondo Yuri Fesko, MD, vice president, medical affairs, oncology, per Quest Diagnostics, il test della malattia minima residua che utilizza un semplice prelievo di sangue per aiutare a identificare le cellule tumorali nel DNA tumorale circolante dopo un trattamento iniziale, sarà adottato in modo più ampio.
“Ci aspettiamo che questo venga adottato più ampiamente, insieme ad altre tecnologie diagnostiche avanzate come il sequenziamento di prossima generazione per l’analisi dei tumori per aiutare a selezionare un trattamento“, afferma. “I medici in genere monitorano i pazienti per diversi anni per rilevare segni di recidiva del cancro, utilizzando test che includono la biopsia tissutale o l’imaging. Tuttavia, le biopsie e l’imaging possono essere invasivi, scomodi o costosi, quindi i test della MRD forniscono un modo nuovo e complementare per aiutare a monitorare longitudinalmente nel tempo il cancro residuo o ricorrente attraverso un semplice esame del sangue. Quest’anno a circa 1,9 milioni di persone verrà diagnosticato un cancro. I casi di cancro continuano ad aumentare in tutto il Paese, con picchi di casi più aggressivi anche per alcuni tipi di cancro e tra i più giovani. Strumenti di medicina di precisione come quelli in grado di testare la MRD saranno fondamentali per affrontare la recidiva del cancro, non solo nel 2024, ma oltre, e contribuiranno a garantire risultati sanitari migliori”.
#12 – Il sequenziamento di nuova generazione migliorerà lo screening neonatale
Il sequenziamento di nuova generazione (NGS) è stato utilizzato per testare un’ampia gamma di patologie nel laboratorio clinico, ma offre ai medici strumenti potenti per fornire assistenza ai neonati, secondo Madhuri Hegde, FACMG, SVP e direttore scientifico di Revvity.
“Il sequenziamento di prossima generazione (NGS) sta fornendo informazioni efficienti e olistiche sul genoma umano, che è diventata un’opzione praticabile per lo screening a livello di popolazione, compreso lo screening neonatale (NBS)”, afferma Hegde. “Un recente studio condotto da Revvity Omics ha dimostrato il valore clinico dello screening proattivo basato sul sequenziamento in neonati apparentemente sani. L’uso dello screening genomico proattivo consentirebbe agli operatori sanitari di scoprire un’ampia gamma di rischi per le incombenti patologie ad esordio pediatrico, consentendo interventi precoci e piani di trattamento personalizzati basati sulla composizione genetica individuale. Man mano che NGS diventa sempre più accessibile al grande pubblico, sfruttare questo strumento potrebbe avere un profondo impatto sulla salute e sul benessere delle famiglie e delle generazioni future”.
#13 – Ci sarà un ulteriore consolidamento dei laboratori clinici e delle società diagnostiche
La pandemia ha offerto alle aziende molte opportunità e ha reso il valore dei test una priorità per clienti e stakeholder. Tuttavia, Blum prevede che ciò abbia avuto un costo costante: il consolidamento.
“Una delle caratteristiche sorprendenti della conferenza AACC/ADLM del 2023 è stata la moltitudine di aziende che ora sono sotto l’egida di società diagnostiche più grandi. I vari nomi e loghi aziendali che apparivano sulle pareti dei congressi erano una sorta di “NASCAR del settore dei laboratori e della diagnostica”. Con il declino del COVID e la conseguente diminuzione delle entrate dei test obbligatori, le aziende diagnostiche e i laboratori sono stati costretti a recuperare per le perdite finanziarie in vari modi, inclusi licenziamenti, chiusure e aumento di fusioni e acquisizioni. Ulteriori fattori trainanti di questo consolidamento includono i tagli proposti in corso al rimborso per i test di laboratorio da parte di PAMA e una sempre minore forza lavoro di professionisti qualificati”, osserva. “Le aziende stanno diversificando le tecnologie di test e le aree di interesse e cercando nuovi flussi di entrate in segmenti ausiliari per integrare la diminuzione della domanda e le pressioni economiche. Con l’economia in recessione, sembra che il trend di consolidamento continuerà nel 2024, soprattutto perché cresce l’incertezza su chi guiderà il Paese [Stati Uniti d’America] nel 2025”.
#14 – L’innovazione nei test multidroga d’abuso diventerà comune
Per certi versi messa in ombra dalla pandemia, la crisi degli oppioidi sta ora diventando una priorità, in particolare con l’arrivo sulla scena di nuovi farmaci psicoattivi. Ciò richiederà una continua innovazione nei test, secondo Jack Kain, PharmD, direttore e collegamento per le scienze mediche, Drug Monitoring & Toxicology per Quest Diagnostics.
“Negli ultimi 10-15 anni, l’epidemia di oppioidi ha continuato ad evolversi, attraversando periodi pieni di abuso di oppioidi da prescrizione e, negli ultimi anni, di fentanil. Prevedo che il 2024 segnerà una nuova fase: l’epidemia delle nuove droghe psicoattive. Le nuove sostanze psicoattive (NPS) sono una gamma di farmaci progettati per imitare le droghe illecite consolidate come cannabis, cocaina, MDMA e LSD. I produttori illeciti di questi farmaci sviluppano nuove sostanze chimiche per sostituire quelle vietate, rendendo gli effetti a lungo termine di queste sostanze impossibili da monitorare da parte dei medici e imprevedibili per coloro che le usano”, afferma Kain. “Mentre il NIDA segnala che i decessi legati a oppioidi sintetici e stimolanti continuano ad aumentare in tutto il paese, l’emergere di questi nuovi farmaci sintetici ha eluso il rilevamento con gli attuali metodi di test. Le NPS devono essere monitorate per prevenire danni alle comunità, ma molti laboratori attualmente non le stanno testando. Prevediamo che i laboratori svilupperanno nuovi metodi di test nel 2024 come la xilazina e altre NPS che emergono come minacce per la salute pubblica”.
#15 – La ricerca per vivere più a lungo spingerà ulteriormente la diagnostica nel mondo del consumismo
La pandemia ha causato un cambiamento nel modo in cui le persone gestiscono tutti gli aspetti della propria salute, e Bracken prevede che ciò continui in modo profondo anche nel 2024.
“La pandemia ha cambiato per sempre il modo in cui le persone pensano ai test diagnostici. Una volta non si pensava molto a sottoporsi a prelievi di sangue presso lo studio del medico o in un luogo di raccolta, ma il COVID ha aperto le porte all’autoprelievo, ai test in nuove posizioni, all’ordinazione delle proprie analisi del sangue direttamente da un laboratorio e ad altri processi non tradizionali,” afferma. “Un colpo di scena inaspettato è stata l’ascesa degli influencer dei social media che hanno suscitato interesse per il concetto di longevità. Gli influencer non si limitano più a consigliare prodotti, ma portano con sé i loro affascinati follower nella ricerca per vivere una vita più lunga e più sana. In effetti, dati recenti rivelano che nell’ultimo anno i pazienti hanno riposto maggiore fiducia nei loro amici e familiari quando si tratta di informazioni sanitarie, portando l’influenza dei pari a un livello equivalente di fiducia che ripongono nei medici e negli infermieri. Inoltre, il 44% dei giovani adulti (di età compresa tra 18 e 34 anni) ritiene che la propria ricerca possa renderli altrettanto competenti sulla maggior parte delle questioni sanitarie quanto i medici. Questa mentalità porterà a una maggiore consumerizzazione della diagnostica e a un’attenzione al benessere e alla longevità a un ritmo più accelerato man mano che sempre più persone prenderanno in mano la propria assistenza sanitaria. L’attuale carenza di forza lavoro nel sistema sanitario creerà un’ottima opportunità affinché questo cambiamento avvenga”.
#16 – I test sulle cellule T guadagneranno ulteriore popolarità nella terapia di Long COVID e CAR-T
Secondo James Foster, CEO di Virax Biolabs, i test sulle cellule T offrono una serie di opportunità diagnostiche, in particolare per identificare e aiutare a trattare il COVID a lungo termine e convalidare la terapia con cellule CAR-T.
“Sebbene le terapie con cellule CAR-T abbiano mostrato un notevole successo in alcuni pazienti affetti da cancro, sono necessari metodi di validazione robusti per garantirne la sicurezza e l’efficacia. I test sulle cellule T svolgono un ruolo fondamentale in questo processo di validazione valutando la funzionalità, la specificità e la persistenza delle cellule CAR-T”, afferma. Secondo Foster, il test sulle cellule T aiuta a identificare la funzionalità, confermare la specificità e la persistenza delle terapie cellulari CAR-T a lungo termine.
“I test sulle cellule T sono emersi come un potente strumento per la validazione delle terapie con cellule CAR-T per il trattamento del cancro e per il progresso della ricerca Long COVID-19. La sua capacità di valutare la funzionalità, la specificità e la persistenza delle cellule CAR-T garantisce trattamenti più sicuri ed efficaci per i pazienti affetti da cancro. Allo stesso tempo, nel contesto della lunga durata del COVID-19, i test sulle cellule T aiutano a svelare le complessità della risposta immunitaria, portando potenzialmente a migliori strategie di gestione di questa condizione enigmatica”, aggiunge Foster. “Poiché la ricerca in entrambi i campi continua ad evolversi, è probabile che i test sulle cellule T svolgano un ruolo sempre più vitale nel plasmare il futuro delle terapie con cellule CAR-T e nella nostra comprensione del COVID-19 lungo. Sfruttando la potenza dei test sulle cellule T, possiamo realizzare terapie e approfondimenti innovativi che hanno il potenziale per trasformare il panorama dell’assistenza sanitaria”.
Chris Wolski è caporedattore di CLP.
TORNA ALLE NEWS





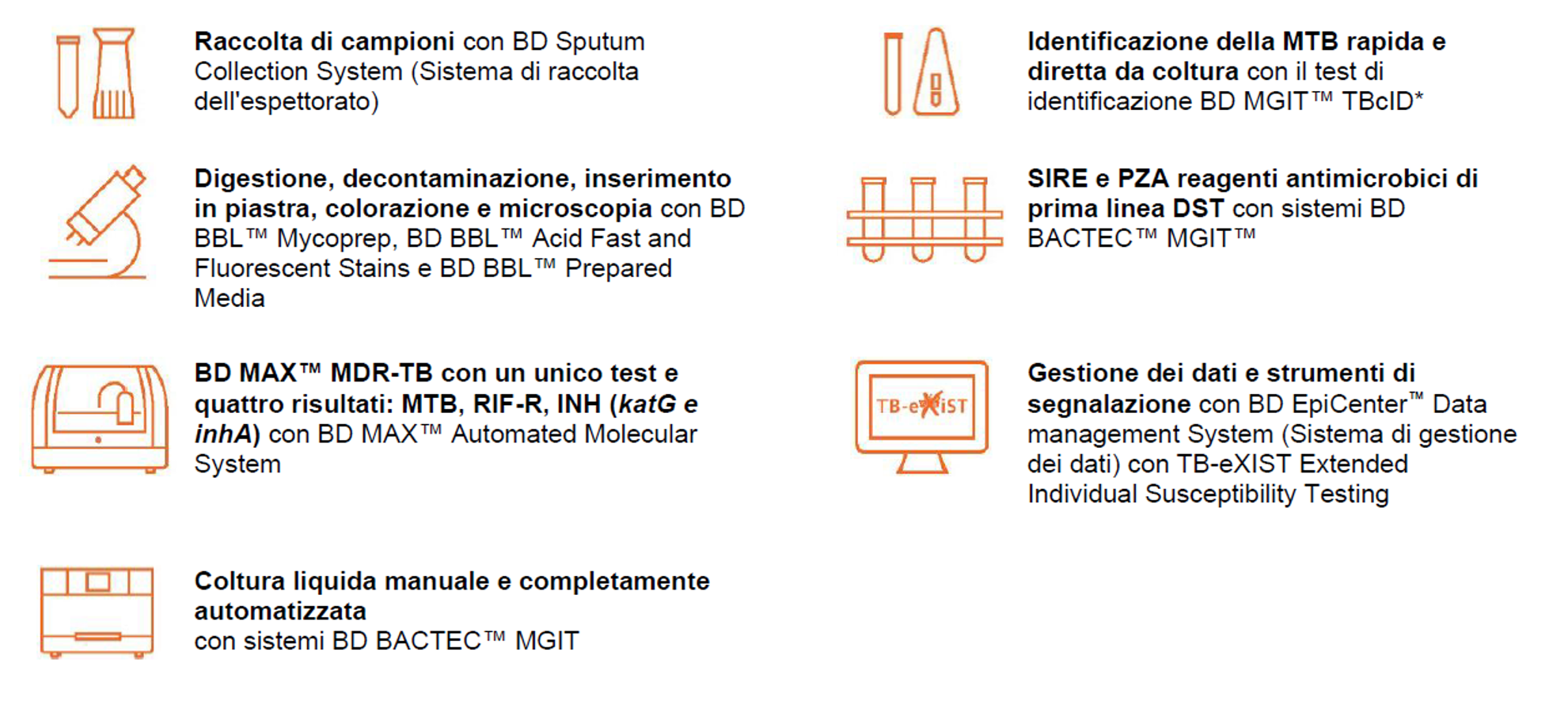
 Si ritiene che nei prossimi 35 anni la MDR-TB costerà all’economia globale 16,7 trilioni di dollari.5 Se le tendenze attuali continueranno, la MDR-TB potrebbe uccidere circa 75 milioni di persone in tutto il mondo entro il 2050.5 Se non tenuta sotto controllo, i modelli hanno stimato che nel tempo la percentuale di tubercolosi resistente ai farmaci continuerà ad aumentare e diventerà più difficile e più costosa da trattare.5
Si ritiene che nei prossimi 35 anni la MDR-TB costerà all’economia globale 16,7 trilioni di dollari.5 Se le tendenze attuali continueranno, la MDR-TB potrebbe uccidere circa 75 milioni di persone in tutto il mondo entro il 2050.5 Se non tenuta sotto controllo, i modelli hanno stimato che nel tempo la percentuale di tubercolosi resistente ai farmaci continuerà ad aumentare e diventerà più difficile e più costosa da trattare.5